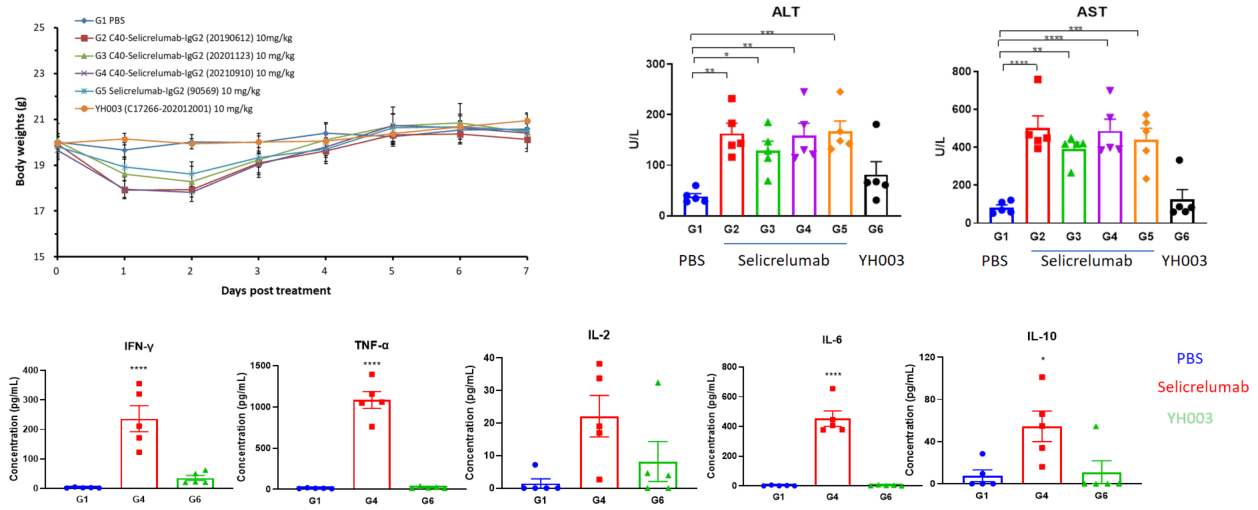
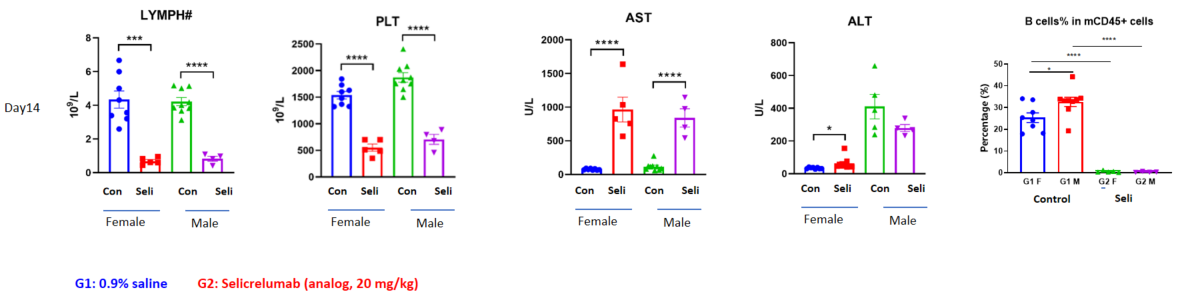
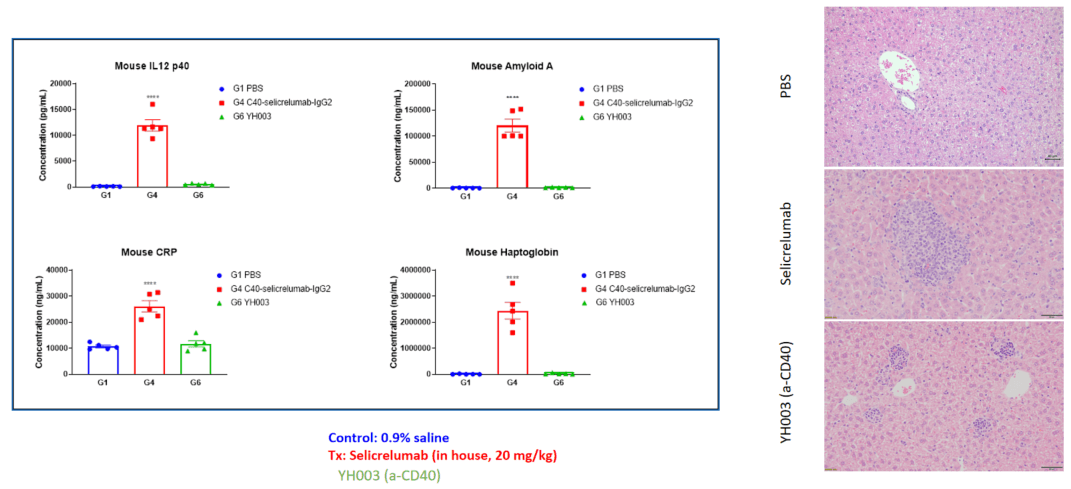
在此页面上
同源模型是将肿瘤移植到遗传背景相同的免疫健全小鼠体内构建而成的模型,能让研究人员在功能完整的免疫系统中研究肿瘤与免疫的相互作用,并评估免疫治疗效果。这类同源小鼠模型为评估免疫应答、药物疗效及联合治疗策略提供了具有生理相关性的体内平台,可保留天然的免疫 - 肿瘤动态关系,为临床前肿瘤免疫研究提供支持。
通过用人类蛋白替换小鼠同源蛋白,基因人源化小鼠模型克服了交叉反应的局限性,能够在药效研究中评估人类或人源化抗体药物,减少了对替代抗体的依赖,同时提升了临床前研究的转化相关性。与免疫缺陷小鼠的人类免疫重建模型相比,这类靶点人源化小鼠模型具有更高的成本效益,且能带来更稳定的实验结果。
为满足创新药物研发日益增长的需求,百奥赛图已开发出一系列靶向单一、双重或多重免疫相关通路的人源化小鼠模型。此外,基于潜在的药物作用机制,我们还建立了相应的人源化肿瘤细胞系,为药效评估提供更全面、且更具转化相关性的体内模型。
请查看以下人源化CD40小鼠的具体案例研究。
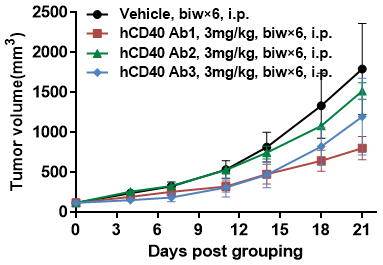
抗人CD40抗体在B-hCD40小鼠中的抗肿瘤活性。
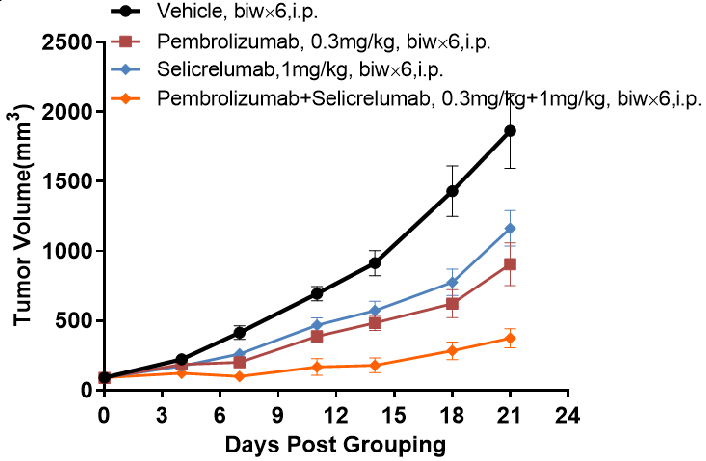
Pembrolizumab和Selicrelumab在B-hPD-1/hPD-L1/hCD40小鼠中的抗肿瘤活性。
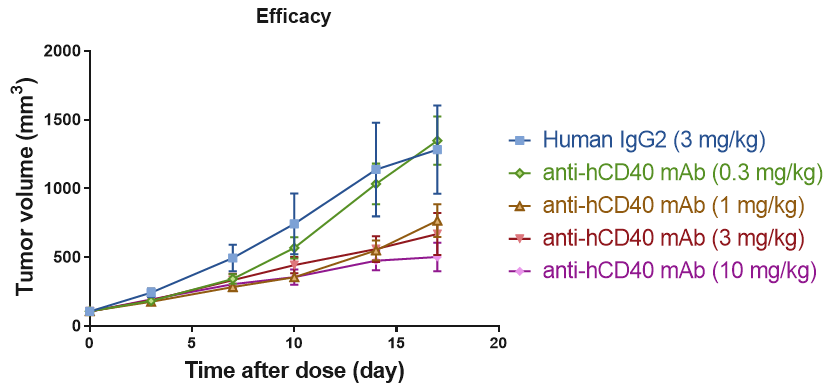
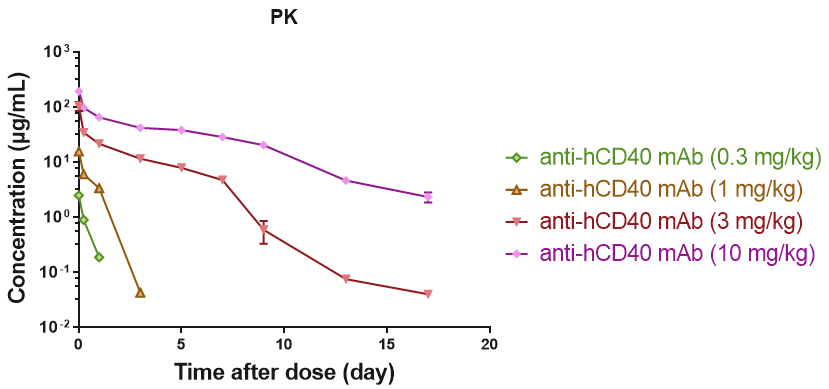
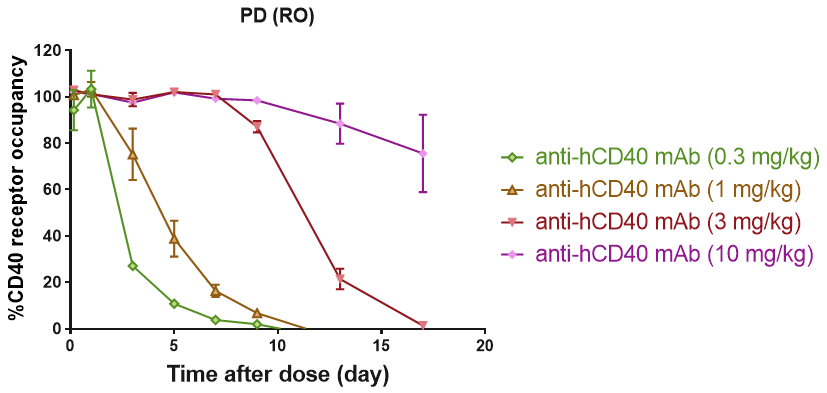
B细胞CD40受体的RO